BEREMAGENE GEPERPAVEC (B-VEC) 5×109 PFU par ml, suspension et gel pour gel à usage cutané, boîte de 1 flacon de 2,50 ml
Dernière révision : 25/09/2024
Taux de TVA : 0%
Laboratoire exploitant : PHARMA BLUE
Beremagene geperpavec (B-VEC) est indiqué pour le traitement des plaies des patients âgés de 6 mois et plus, atteints d'épidermolyse bulleuse dystrophique (EBD) avec mutation(s) du gène de la chaîne alpha 1 du collagène de type VII (COL7A1).
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Exposition accidentelle au beremagene geperpavec (B-VEC)
Beremagene geperpavec (B-VEC) est un vecteur de thérapie génique génétiquement modifié, à réplication défectueuse, basé sur le virus herpès-simplex de type 1. Beremagene geperpavec (B- VEC) ne se réplique pas dans les cellules du sujet et ne s'intègre pas ou n'interagit pas avec le matériel génétique natif des cellules du sujet. Précautions à prendre :
• Éviter tout contact direct avec les plaies traitées (par exemple, toucher ou gratter) et les pansements des plaies traitées pendant environ 24 heures après le traitement.
• Portez des lunettes, un masque et des gants de protection lorsque vous aidez les sujets à changer les pansements et que vous vous occupez de leur élimination.
• En cas d'exposition accidentelle (par exemple, en cas de projection dans les yeux ou sur les muqueuses), rincer à l'eau claire pendant au moins 15 minutes.
Résumé du profil de sécurité
Les données de sécurité décrites dans cette section reflètent principalement l'exposition au gel beremagene geperpavec (B-VEC) dans une étude randomisée, contrôlée par un placebo intra-sujet. Au total, 31 sujets atteints d'épidermolyse bulleuse dystrophique (EBD), dont 30 sujets atteints d'EBD autosomique récessive et un sujet atteint d'EBD autosomique dominante, ont reçu du gel beremagene geperpavec (B-VEC) topique sur leurs plaies.
L'âge des sujets allait de 1 à 44 ans (âge moyen 17 ans). Sur les 31 sujets, 19 (61%) étaient des enfants (moins de 17 ans) et 11 (36%) étaient des femmes. Chaque sujet a reçu une application cutanée hebdomadaire du gel beremagene geperpavec (B-VEC) sur un ou plusieurs sites de la plaie et un placebo sur un site de la plaie correspondant en tant que comparateur intra-sujet. La durée médiane d'exposition au gel beremagene geperpavec (B-VEC) était de 25 semaines. Il n'y a pas eu d'arrêt de traitement en raison d'effets indésirables.
Les effets indésirables les plus fréquemment rapportés (> 5%, 2 sujets ou plus) chez les patients traités par beremagene geperpavec (B-VEC) ont été le prurit, l'érythème, les éruptions cutanées, les frissons, la toux et la rhinorrhée.
Liste tabulée des effets indésirables
Dans le tableau suivant, les effets indésirables sont répertoriés par classe d'organes du système MedDRA et par terme privilégié. Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre de gravité décroissante.
La fréquence des effets indésirables est définie comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) ; très rare (< 1/10 000), non connu (ne peut être estimé à partir des données disponibles).
Le tableau 3 énumère tous les effets indésirables signalés chez plus d'un sujet dans l'étude randomisée, intra-sujet, contrôlée par placebo.
Tableau 1 Effets indésirables
| Système Classe d'organes | Communs |
| Affections de la peau et du tissu sous-cutané | Prurit Erythème Éruption |
| Troubles généraux et conditions du site de l'administration | Frissons |
| Troubles respiratoires, thoraciques et médiastinaux | Toux Rhinorrhée |
En outre, le gel beremagene geperpavec (B-VEC) a fait l'objet d'une étude de prolongation ouverte portant sur 47 sujets, dont 2 âgés de moins d'un an. La durée médiane d'exposition dans l'extension ouverte était de plus de 18 mois. Aucun nouveau signal de sécurité n'a été identifié.
Immunogénicité
Le risque d'exposition systémique à beremagene geperpavec (B-VEC) était minime. Les anticorps contre le vecteur viral (HSV-1) et la protéine transgénique (COL7) ont été évalués dans un sous- ensemble de sujets dans l'étude clinique randomisée, intra-sujet, contrôlée par placebo. Au total, 64 % des sujets évalués (14/22) étaient positifs aux anticorps anti-HSV-1 au départ. Six des 8 sujets séronégatifs pour les anticorps anti-VHS-1 ont séroconverti à la semaine 26 après le traitement par beremagene geperpavec (B-VEC). Chez les sujets disposant d'échantillons de sérum appariés au début et à la fin de l'étude, des anticorps anti-médicaments (ADA) contre COL7 ont été détectés chez 72 % (13/18) des sujets traités par beremagene geperpavec (B-VEC) pendant une période allant jusqu'à 26 semaines. Aucune immunité neutralisante n'a été observée lors d'une première exposition ou d'une exposition répétée à beremagene geperpavec (B-VEC). Aucune réaction immunologique cliniquement pertinente n'a été rapportée.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé doivent déclarer tout effet indésirable suspecté selon les modalités définies dans le Protocole d'utilisation thérapeutique et de recueil de données (voir PUT RD).
PRECAUTIONS à prendre :
- ÉVITER tout contact direct avec les plaies traitées (par exemple,
toucher ou gratter) et les pansements des plaies traitées pendant
environ 24 heures après le traitement.
- PORTER des lunettes, un masque et des gants de protection lors du changement des pansements et de leur élimination.
- En cas d'exposition accidentelle (par exemple, en cas de projection
dans les yeux ou sur les muqueuses), RINCER à l'eau claire pendant au
moins 15 minutes.
INFORMER la patiente des risques potentiels pour le foetus et le nouveau-né si une grossesse débute pendant le traitement.
Grossesse
Il n'existe pas de données sur l'utilisation du gel beremagene geperpavec (B-VEC) chez la femme enceinte. Beremagene geperpavec (B-VEC) n'a pas fait l'objet d'études de toxicité pour le développement et la reproduction chez l'animal.
Les études animales ont indiqué que le beremagene geperpavec (B-VEC) n'était pas détecté au niveau systémique après une utilisation cutanée, et l'utilisation maternelle ne devrait pas entraîner d'exposition du foetus au médicament.
Par mesure de précaution, il est préférable d'éviter l'utilisation de beremagene geperpavec (B-VEC) pendant la grossesse.
Si la patiente débute une grossesse pendant l'administration du gel beremagene geperpavec (B- VEC), elle doit être informée des risques potentiels pour le foetus et le nouveau-né. Les femmes en âge de procréer doivent être informées qu'elles doivent utiliser une méthode de contraception efficace pour éviter toute grossesse pendant le traitement par le gel beremagene geperpavec (B-VEC).
Allaitement
On ne sait pas si le beremagene geperpavec (B-VEC) est excrété dans le lait maternel.
Il faut décider d'interrompre l'allaitement ou d'interrompre/de s'abstenir de suivre le traitement par beremagene geperpavec (B-VEC) en tenant compte du bénéfice de l'allaitement pour l'enfant et du bénéfice du traitement pour la femme
Fertilité
Aucune étude clinique ou non clinique n'a été réalisée pour évaluer l'effet de beremagene geperpavec (B-VEC) sur la fertilité. Les études animales n'ont pas révélé d'effets nocifs directs ou indirects sur les organes reproducteurs (voir section Données de sécurité préclinique). Le beremagene geperpavec (B-VEC) n'a pas été détecté au niveau systémique après une utilisation cutanée et son utilisation ne devrait pas avoir d'effets néfastes sur la fertilité.
Aucune étude d'interaction médicamenteuse n'a été réalisée avec le beremagene geperpavec (B- VEC). Les interactions avec les médicaments topiques n'ont pas été étudiées dans le cadre d'essais cliniques. D'autres médicaments topiques ne doivent pas être utilisés en même temps que beremagene geperpavec (B-VEC).
La sécurité de l'immunisation avec des vaccins à virus vivant pendant ou après le traitement par beremagene geperpavec (B-VEC) n'a pas été étudiée. Cependant, il n'y a pas de données suggérant que beremagene geperpavec (B-VEC) interfère de quelque manière que ce soit avec la capacité de l'organisme à répondre de manière appropriée à un vaccin à virus vivant.
Beremagene geperpavec (B-VEC) est un médicament réservé à l'usage hospitalier dont la prescription est réservée aux spécialistes en dermatologie. Il doit être appliqué par un professionnel de santé, que ce soit à l'hôpital ou à domicile, dans le cadre d'une hospitalisation à domicile (HAD).
Posologie
La dose recommandée de beremagene geperpavec (B-VEC) gel est fonction de l'âge. Le tableau 1 présente le schéma posologique maximal recommandé par groupe d'âge.
Le gel beremagene geperpavec (B-VEC) est appliqué par voie cutanée sur la/les plaie(s) une fois par semaine.
Tableau 1 Dose hebdomadaire maximale par âge
| Tranche d'âge | Dose hebdomadaire maximale (unités formatrices de plaques ; UFP) | Volume hebdomadaire maximal (millilitres ; ml)* |
| 6 mois à <3 ans | 2×109 | 1.0 |
| ≥3 ans | 4×109 | 2.0 |
*Volume hebdomadaire maximum après mélange de la suspension beremagene geperpavec (B-VEC) avec le gel.
Il se peut qu'il ne soit pas possible d'appliquer le gel beremagene geperpavec (B-VEC) sur toutes les plaies à chaque visite de traitement.
Appliquer le gel beremagene geperpavec (B-VEC) sur les plaies, en commençant par la plaie cible, jusqu'à ce qu'elles soient fermées avant de sélectionner une ou plusieurs nouvelles plaies à traiter Il se peut qu'il ne soit pas possible d'appliquer le gel beremagene geperpavec (B-VEC) sur toutes les plaies à chaque visite de traitement. Traiter en priorité chaque semaine les plaies déjà traitées si elles se rouvrent.
En cas d'oubli d'une dose, administrer beremagene geperpavec (B-VEC) gel dès que possible et reprendre la dose hebdomadaire par la suite.
Population pédiatrique
Les études cliniques de beremagene geperpavec (B-VEC) n'ont pas inclus d'enfants de moins de 6 mois.
Utilisation en gériatrie
Les études cliniques sur beremagene geperpavec (B-VEC) n'ont pas inclus de patients âgés de 45 ans et plus.
Mode d'administration
Usage cutané (externe) sur les plaies uniquement.
Préparer le gel beremagene geperpavec (B-VEC) à la pharmacie sous environnement PSM2 ou équivalent en mélangeant la suspension beremagene geperpavec (B-VEC) au gel pour une utilisation immédiate ou dans les 168 heures (7 jours) suivant la préparation, en conservant les seringues d'administration à une température comprise entre 2 et 8°C, voir section Précautions particulières de conservation.
Un médecin ou une infirmière doit appliquer le gel beremagene geperpavec (B-VEC), soit dans un établissement de soins de santé (par exemple, une clinique), soit à domicile.
Les personnes enceintes ne doivent pas préparer ou administrer le gel beremagene geperpavec (B- VEC) et doivent éviter tout contact direct avec les plaies traitées ou les pansements des plaies traitées.
Pour des instructions détaillées sur la préparation, l'administration, les mesures à prendre en cas d'exposition accidentelle et l'élimination de beremagene geperpavec (B-VEC), voir la section Précautions particulières d'élimination et de manipulation. sur les précautions à prendre avant la manipulation ou l'administration du médicament.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique Précautions particulières d'élimination et de manipulation.
Durée de conservation :
24 mois à une température comprise entre -15°C et -25°C.
Précautions particulières de conservation :Conserver le carton d'étagère à une température comprise entre -15°C et -25°C. S'il n'y a pas de congélateur, le carton peut être réfrigéré à une température comprise entre 2 et 8°C pendant un mois maximum.
Les seringues d'administration peuvent être conservées et transportées jusqu'à 168 heures (7 jours) à une température comprise entre 2 et 8°C.
Jeter le matériel s'il n'entre pas dans les paramètres ci-dessus.
Sans objet.
L'expérience clinique du surdosage de beremagene geperpavec (B-VEC) est limitée. Un traitement symptomatique et de soutien, jugé nécessaire par le médecin traitant, est conseillé en cas de surdosage.
Classe pharmacothérapeutique : {Produits dermatologiques, Préparations pour le traitement des plaies et des ulcères, cicatrisants, Autres cicatrisants}, code ATC : {D03AX16}.
Mécanisme d'action
L'EBD est causé par des mutations dans le gène COL7A1, ce qui entraîne des niveaux réduits ou absents de COL7 biologiquement actif.
Lors de l'application cutanée sur les plaies, beremagene geperpavec (B-VEC) peut transduire à la fois les kératinocytes et les fibroblastes. Après l'entrée de beremagene geperpavec (B-VEC) dans les cellules, le génome du vecteur est déposé dans le noyau. Une fois dans le noyau, la transcription du COL7A1 humain codé est initiée. Les transcriptions qui en résultent permettent la production et la sécrétion de COL7 par la cellule sous sa forme mature. Ces molécules de COL7 s'organisent en faisceaux longs et fins qui forment des fibrilles d'ancrage. Les fibrilles d'ancrage maintiennent l'épiderme et le derme ensemble et sont essentielles au maintien de l'intégrité de la peau.
Effets pharmacodynamiques
L'activité pharmacodynamique (expression et localisation de COL7 pleine longueur) du gel beremagene geperpavec (B-VEC) a été démontrée dans une première étude clinique (n=6 sujets). Beremagene geperpavec (B-VEC) a favorisé la restauration de l'intégrité de la peau, comme le montrent le dépôt linéaire de COL7 pleine longueur et la formation ultérieure de fibrilles d'ancrage à la jonction dermo-épidermique dans les biopsies cutanées prélevées après le traitement par beremagene geperpavec (B-VEC).
Efficacité et sécurité clinique
L'efficacité du gel beremagene geperpavec (B-VEC) chez les sujets âgés d'un an et plus atteints de DEB avec mutation(s) dans le gène COL7A1 a été évaluée dans le cadre d'un essai contrôlé randomisé. Tous les sujets de l'étude présentaient des manifestations cliniques compatibles avec le DEB et des mutations génétiquement confirmées dans le gène COL7A1. Deux plaies comparables chez chaque sujet ont été sélectionnées et randomisées pour recevoir soit une application cutanée du gel beremagene geperpavec (B-VEC), soit le placebo (gel seul) chaque semaine pendant 26 semaines.
L'étude a porté sur 31 sujets (20 hommes et 11 femmes), dont 30 sujets atteints d'une forme autosomique récessive de la maladie et un sujet atteint d'une forme autosomique dominante de la maladie. L'âge moyen des sujets était de 17 ans (de 1 an à 44 ans), dont 61 % de sujets pédiatriques (n=19, âge de 1 an à < 17 ans). Soixante-quatre pour cent des sujets étaient blancs, 19 % étaient asiatiques et le reste était indien d'Amérique ou originaire d'Alaska.
L'efficacité a été établie sur la base d'une amélioration de la cicatrisation des plaies définie comme la différence dans la proportion de fermeture complète (100 %) des plaies à 24 semaines, confirmée lors de deux visites consécutives à 2 semaines d'intervalle, évaluées aux semaines 22 et 24 ou aux semaines 24 et 26, entre les plaies traitées par le gel beremagene geperpavec (B-VEC) et les plaies traitées par le gel placebo. L'efficacité a été confirmée par la différence dans la proportion de fermeture complète de la plaie évaluée aux semaines 8 et 10 ou aux semaines 10 et 12 entre les plaies traitées par le gel beremagene geperpavec (B-VEC) et celles traitées par le gel placebo. La fermeture complète (100 %) de la plaie a été définie comme une fermeture durable de la plaie évaluée lors de deux visites consécutives à deux semaines d'intervalle. Les résultats d'efficacité sont résumés dans le Tableau 4.
Tableau 2 Point final primaire et point final secondaire clé*
| Délais d'évaluation de la fermeture de la plaie | Plaies primaires exposées au beremagene geperpavec (B- VEC) (N=31) | Plaies primaires exposées au placebo (N=31) | Différence absolue (IC 95 %) | Valeur p |
| Critère d'évaluation principal : | 20.9 (67) | 6.7 (22) | 46 | 0.002 |
| cicatrisation complète de la plaie à 6 mois†‡. | | | (24-68) | |
| Délais d'évaluation de la fermeture de la plaie | Plaies primaires exposées au beremagene geperpavec (B- VEC) (N=31) | Plaies primaires exposées au placebo (N=31) | Différence absolue (IC 95 %) | Valeur p |
| Critère d'évaluation secondaire clé : cicatrisation complète de la plaie à 3 mois‡ | 21.9 (71) | 6.1 (20) | 51 (29-73) | <0.001 |
*Les critères d'évaluation principaux
et secondaires ont été analysés dans la population en intention de
traiter. Des méthodes d'imputation multiple ont été utilisées pour
tenir compte des données manquantes. Les nombres fractionnaires sont
dus à la procédure d'imputation multiple utilisée pour l'analyse. Les
tests d'hypothèse ont été effectués à l'aide du test exact de McNemar.
†Les plaies primaires ont été évaluées aux semaines 22 et 24 ou aux semaines 24 et 26.
‡Les plaies primaires ont été évaluées aux semaines 8 et 10 ou aux semaines 10 et 12.
†Les plaies primaires ont été évaluées aux semaines 22 et 24 ou aux semaines 24 et 26.
‡Les plaies primaires ont été évaluées aux semaines 8 et 10 ou aux semaines 10 et 12.
L'intensité de la douleur pendant le pansement de la plaie, telle qu'évaluée par l'échelle visuelle analogique (EVA) pour les sujets âgés de 6 ans et plus, a également été évaluée en tant que critère d'évaluation secondaire. Une tendance constante à la diminution de la douleur en faveur de beremagene geperpavec (B-VEC) a été observée au cours des semaines 22 (p=0,02), 24 (p=0,06) et 26 (p=0,07).
Population pédiatrique
L'Agence européenne des médicaments a reporté l'obligation de soumettre les résultats des études menées avec beremagene geperpavec (B-VEC) dans un ou plusieurs sous-ensembles de la population pédiatrique dans l'épidermolyse bulleuse dystrophique (voir la section Posologie et mode d'administration pour des informations sur l'utilisation pédiatrique).
Dans l'essai de confirmation, des évaluations de l'exposition systémique et environnementale potentielle ont été effectuées lors de visites hebdomadaires sur le site clinique par la quantification des génomes beremagene geperpavec (B-VEC) dans le sang, l'urine, les écouvillons de peau et les échantillons de bandage (excrétion du vecteur) à l'aide d'un test qPCR validé, et par la détection de particules virales infectieuses dans les écouvillons de peau (infectivité) à l'aide d'un test validé du titre de la plaque.
Tous les échantillons de sang et tous les échantillons d'urine, sauf un, prélevés tout au long de l'étude étaient inférieurs à la limite de détection/quantification pour tous les sujets, ce qui indique qu'il n'y a pas eu d'exposition systémique significative des sujets au vecteur. La plupart des pansements (67,7 %) contenaient des génomes de vecteurs détectables. Seul un très petit nombre d'écouvillons de peau (2,4 %) contenait des génomes de vecteurs détectables. Cependant, aucune particule infectieuse extracellulaire n'a été détectée sur la surface de la peau des sujets, quel que soit le moment testé, ce qui suggère un confinement localisé et une transduction efficace des plaies cutanées après l'application topique de beremagene geperpavec (B-VEC).
Les études non cliniques de biodistribution et d'excrétion du vecteur menées dans le cadre des BPL étaient favorables et indiquaient l'absence d'exposition systémique après une administration topique localisée de beremagene geperpavec (B-VEC).
En raison de l'administration localisée et du confinement au site d'utilisation cutanée sans exposition systémique, beremagene geperpavec (B-VEC) n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
Les données non cliniques n'ont révélé aucun risque particulier pour l'homme sur la base d'études conventionnelles d'administration de doses uniques et répétées dans le cadre d'études toxicologiques BPL.
En raison de la faible sévérité des résultats et de l'absence d'impact sur la santé et le bien-être des animaux auxquels on a administré 3,45×107 PFU/jour par voie IV ou 3,48×107 PFU par voie topique sur une plaie cutanée, ces doses ont été considérées comme non nocives. Des formulations de 6,9×106 PFU/jour de Vyjuvek ont été tolérées lorsqu'elles ont été administrées par injection intradermique une fois par semaine pour une ou cinq doses.
Aucune étude de toxicité pour le développement et la reproduction n'a été menée chez l'animal.
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude n'a été menée pour évaluer les effets de beremagene geperpavec (B-VEC) sur la cancérogenèse, la mutagenèse ou l'altération de la fertilité
Précautions à prendre avant de manipuler ou d'administrer le médicament
Suivre les directives locales pour la manipulation et l'administration d'une thérapie génique (ou d'un organisme génétiquement modifié), l'équipement de protection individuelle, les déversements accidentels et l'élimination des déchets.
Ce médicament contient des organismes génétiquement modifiés. Une mention relative à la présence d'OGM dans l'ensemble des déchets, produits lors de la préparation et l'utilisation de ce médicament de thérapie génique, devra être ajoutée avant élimination, si ces déchets ne sont pas inactivés sur place.
Tout médicament non utilisé ou déchet doit être éliminé conformément aux exigences locales.
Préparation avant l'administration
Préparer beremagene geperpavec (B-VEC) pour l'administration
Vous trouverez ci-dessous la liste des fournitures nécessaires à la préparation du gel de beremagene geperpavec (B-VEC).
• Un (1) carton contenant un (1) flacon de suspension beremagene geperpavec (B-VEC) et un (1) flacon de gel (Figure 1)
• Aiguilles de calibre 18
• Seringues d'administration de 1mL
• Seringue de préparation de 3mL
• Bouchons de seringue
• Gants, un masque et des lunettes de protection.
• Tampons d'alcool isopropylique à 70
• Conteneur à risques biologiques
• Étiquette pour les seringues d'administration
• Agent virucide pour le nettoyage
Suivez les étapes ci-dessous pour la préparation du gel beremagene geperpavec (B-VEC).
Préparer la seringue de préparation.
1. Se laver les mains et mettre des lunettes, un masque et des gants de protection.
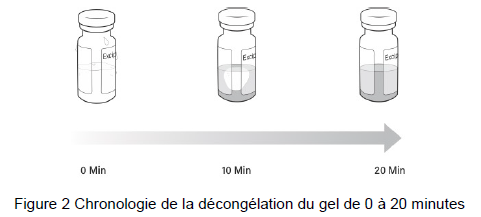
2. Retirer les deux flacons du carton et décongeler le flacon de suspension beremagene geperpavec (B-VEC) et le flacon de gel à température ambiante pendant au moins 20 minutes(Figure 1).
Note : Inspecter visuellement les flacons pour s'assurer qu'ils sont tous deux sous forme liquide et complètement décongelés.
Le gel est plus visqueux et prendra plus de temps à décongeler (Figure 2).
Note : Une fois que la suspension beremagene geperpavec (B-VEC) ou le gel est décongelé, ne pas recongeler.
3. Inverser le flacon de suspension beremagene geperpavec (B-VEC) 4 à 5 fois. Ne pas retourner le flacon de gel.
4. Retirez les capuchons des flacons et nettoyez chaque bouchon de flacon avec un tampon d'alcool isopropylique à 70 %. Laissez-les sécher.
5. Connecter de manière aseptique une aiguille de calibre 18 à la seringue de préparation de 3 ml.
6. Retirer le capuchon de l'aiguille et percer le bouchon du flacon de suspension beremagene geperpavec (B-VEC).
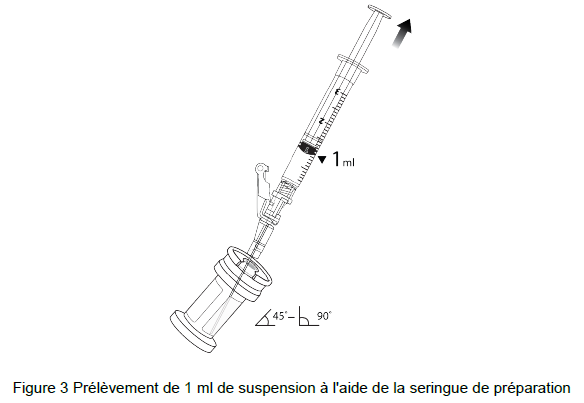
7. Tenir le flacon à 45-90 degrés et prélever 1 ml de suspension beremagene geperpavec (B- VEC) dans la seringue de préparation (Figure 3).
8. Retirez la seringue de préparation (toujours connectée à l'aiguille) contenant 1 ml de suspension beremagene geperpavec (B-VEC) du flacon. N'engagez PAS le verrou de sécurité.
9. Jeter le flacon de suspension beremagene geperpavec (B-VEC) dans les déchets biologiques.
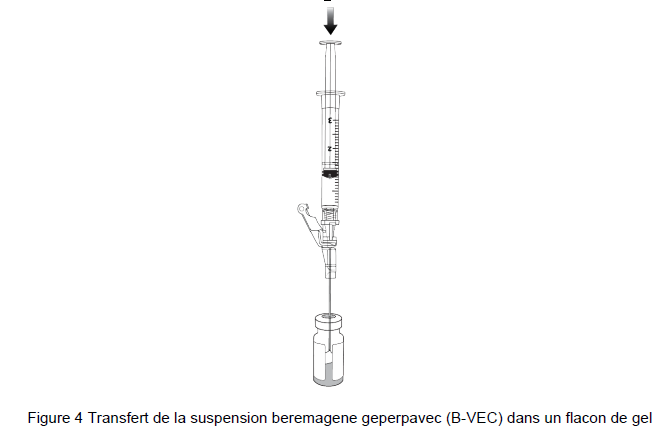
10. Percer le bouchon de gel propre et transférer la suspension beremagene geperpavec (B-VEC) dans le flacon de gel (Figure 4).
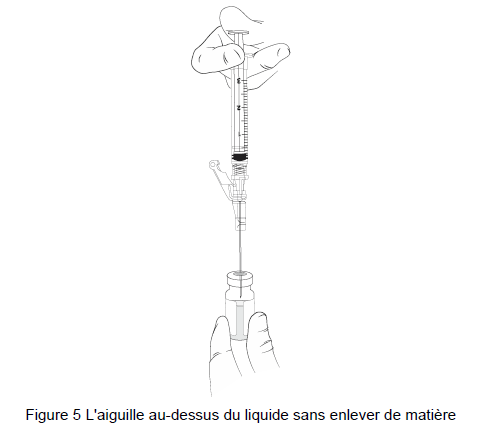
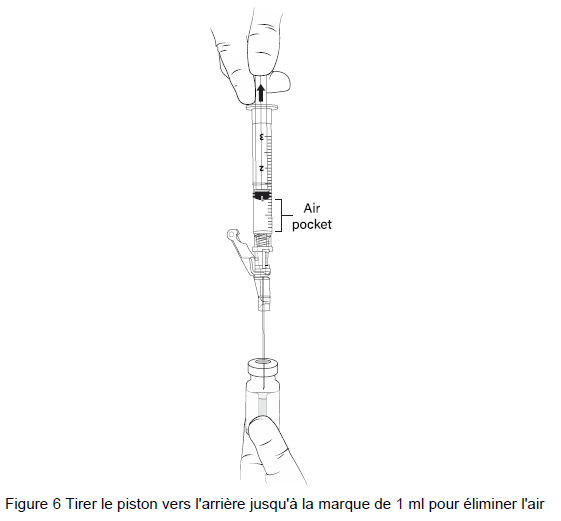
11. SANS RETIRER L'AIGUILLE du flacon de gel, soulever le biseau de l'aiguille au-dessus du liquide (Figure 5) et tirez le piston jusqu'à la marque de 1 mL (Figure 6).
12. Retirez la seringue de préparation contenant 1 ml d'air et enclenchez le verrou de sécurité.
13. Jeter la seringue et l'aiguille de préparation dans les déchets biologiques.
14. Placer un tampon d'alcool isopropylique à 70 % sur le bouchon de gel et le maintenir fermement en place.
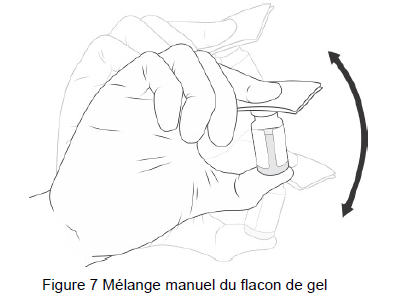
15. Agiter VIGOUREUSEMENT pendant 10 SECONDES (Figure7).
Note : Le mélange de la suspension et du gel beremagene geperpavec (B-VEC) est appelé gel beremagene geperpavec (B-VEC).
PRÉPARER LES SERINGUES D'ADMINISTRATION
16. Connecter de manière aseptique une aiguille de calibre 18 à la première seringue d'administration de 1 ml et retirer le capuchon de l'aiguille.
17. Insérer l'aiguille de calibre 18 dans le flacon contenant le gel de beremagene geperpavec (B- VEC) (Figure 8).
18. Incliner le flacon de 45 à 90 degrés et prélever 0,5 ml de gel de beremagene geperpavec (B- VEC) (Figure9).
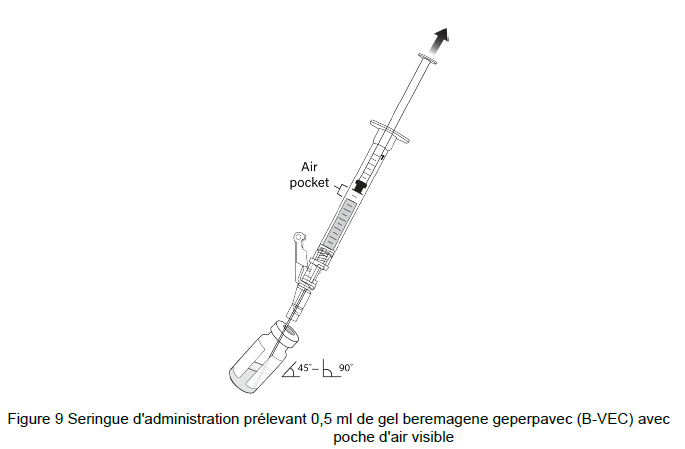
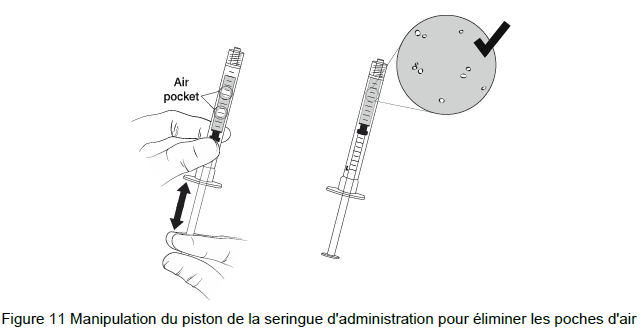
Note : Une poche d'air peut se former près du piston lors de l'extraction du gel beremagene geperpavec (B-VEC).
19. NE PAS RETIRER L'AIGUILLE DU FLACON ; soulever le biseau de l'aiguille au-dessus du gel beremagene geperpavec (B-VEC) et déconnecter la seringue d'administration contenant 0,5 ml de beremagene geperpavec (B-VEC) mélangé (Figure 10).
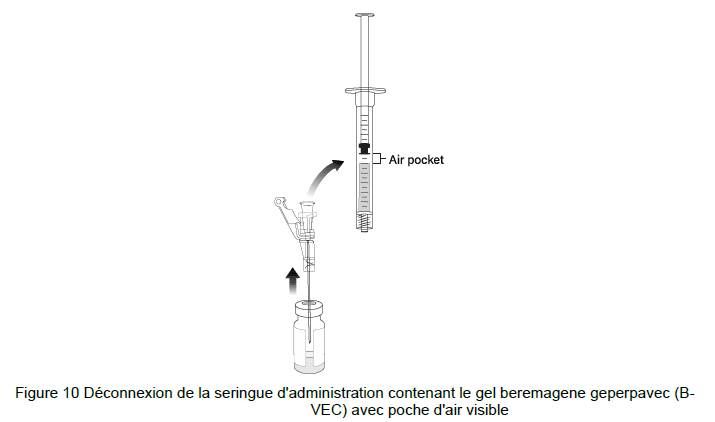
20. NE PAS secouer la seringue pour éliminer la poche d'air. Manipuler le piston de haut en bas jusqu'à ce que toutes les poches d'air aient été éliminées (Figure 11)
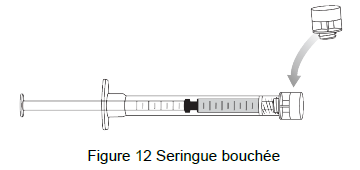
21. Boucher la seringue d'administration et la mettre de côté (Figure 12).
22. Connecter une nouvelle seringue d'administration de 1 ml à l'aiguille qui reste dans le bouchon du flacon de gel (avec le biseau de l'aiguille AU-DESSUS du gel beremagene geperpavec) (B-VEC) (Figure 13).
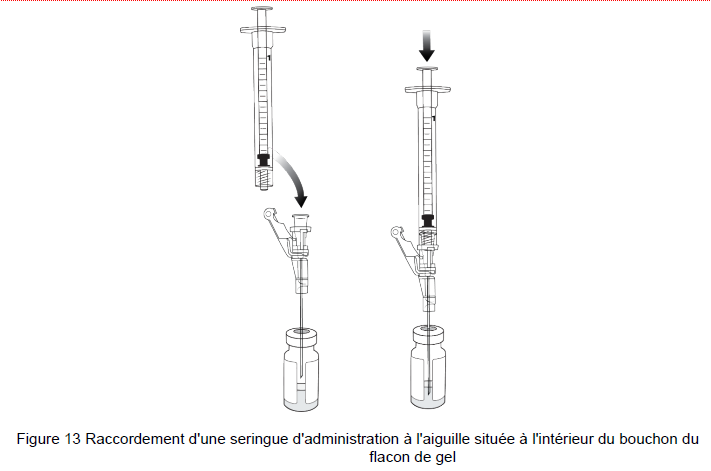
23. Placer le biseau de l'aiguille dans le gel beremagene geperpavec (B-VEC), incliner le flacon de 45 à 90 degrés et prélever 0,5 ml de gel beremagene geperpavec (B-VEC) dans la seringue d'administration [voir étapes 16 et 17] : Figure 8 et Figure 9)].
24. Effectuez les étapes 18, 19 et 20 ci-dessus pour déconnecter la seringue d'administration et éliminer les poches d'air, avant de boucher la seringue d'administration (Figure 10, Figure11et Figure 12).
25. Répétez les étapes 21, 22 et 23 pour les seringues d'administration supplémentaires si nécessaire (chacune contenant 0,5 ml de gel beremagene geperpavec (B-VEC)).
26. Jeter le flacon de gel (avec l'aiguille dans le bouchon du flacon) dans le conteneur pour déchets biologiques.
27. Nettoyer toutes les surfaces qui ont pu entrer en contact avec la suspension ou le gel beremagene geperpavec (B-VEC) et traiter toutes les taches avec un agent virucide tel que l'alcool isopropylique à 70 %, le peroxyde d'hydrogène à 6 % ou le chlorure d'ammonium à<0,4 %. Éponger à l'aide de matériaux absorbants.
28. Jeter tout le matériel (par exemple, le flacon, la seringue, l'aiguille, le matériel de nettoyage) ayant pu entrer en contact avec la suspension ou le gel beremagene geperpavec (B-VEC) dans un sac ou un conteneur à risque biologique.
29. Placer les seringues d'administration bouchées contenant le gel beremagene geperpavec (B- VEC) dans un sac en plastique scellable.
30. Placer le sac en plastique scellable contenant les seringues d'administration dans un conteneur secondaire isolé approprié à une température comprise entre 2 et 8°C pour le transport entre le site de préparation et le site d'administration.
Instructions administratives
Vous trouverez ci-dessous la liste des fournitures nécessaires à l'administration du gel beremagene geperpavec (B-VEC) :
• Les seringues d'administration
• Pansement hydrophobe non adhérent
• Ciseaux
• Pansements standards
• Gants, un masque et des lunettes de protection
• Récipient pour risques biologiques
• Agent virucide pour le nettoyage
Utiliser le gel beremagene geperpavec (B-VEC) dans les seringues d'administration immédiatement après la préparation. Si l'utilisation immédiate n'est pas possible, veuillez-vous référer à la section Error! Reference source not found..
AMINISTRATION DU GEL BEREMAGENE GEPERPAVEC (B-VEC)
Suivez les étapes ci-dessous pour l'administration du gel beremagene geperpavec (B-VEC).
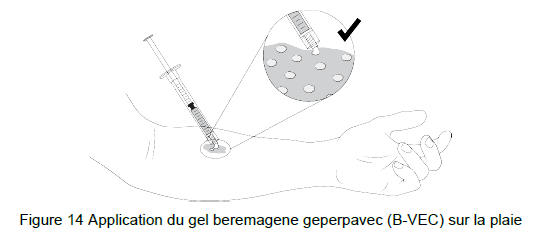
• Appliquer le gel beremagene geperpavec (B-VEC) sur la (les) plaie(s) sélectionnée(s) en gouttelettes espacées uniformément à l'intérieur de la plaie, d'environ 1 cm par 1 cm. La répartition des gouttelettes doit ressembler à une grille. Évitez de toucher la peau avec la seringue d'administration (Figure 14).
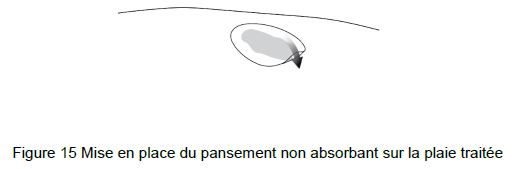
• Utiliser des ciseaux propres pour couper le pansement non absorbant à une taille légèrement supérieure à celle de la plaie et placer le pansement sur les gouttelettes de gel beremagene geperpavec (B-VEC) pour former une fine couche de gel (Figure 15).
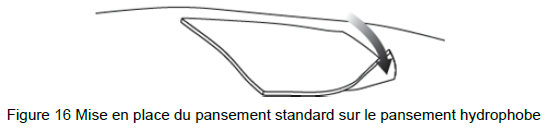
• Utilisez les ciseaux pour couper le pansement standard utilisé par le patient à une taille légèrement supérieure à celle du pansement et placez le pansement standard sur le pansement hydrophobe (Figure 16).
• Nettoyer toutes les surfaces susceptibles d'avoir été en contact avec le gel beremagene geperpavec (B-VEC) et traiter toutes les taches avec un agent virucide tel que l'alcool isopropylique à 70 %, le peroxyde d'hydrogène à 6 % ou le chlorure d'ammonium à <0,4 %. Éponger à l'aide de matériaux absorbants.
• Jeter tout le matériel (par exemple, seringue, matériel de nettoyage) ayant pu entrer en contact avec la suspension ou le gel beremagene geperpavec (B-VEC) dans un sac ou un conteneur à risque biologique.
• Après l'administration, jeter les seringues d'administration dans un sac ou un conteneur à risque biologique.
Ne pas changer le pansement de la plaie dans les 24 heures environ suivant l'application du gel beremagene geperpavec (B-VEC).
Précautions à prendre pour l'élimination du médicament
Jeter tout le matériel (par exemple, le flacon, la seringue, l'aiguille, le matériel de nettoyage) ayant pu entrer en contact avec la suspension ou le gel beremagene geperpavec (B-VEC) dans un sac ou un conteneur à risque biologique.
Après l'administration, jeter les seringues d'administration dans un sac ou un conteneur à risque biologique.
Désinfectez les pansements du premier changement de pansement avec un agent virucide, tel que de l'alcool isopropylique à 70 %, du peroxyde d'hydrogène à 6 % ou du chlorure d'ammonium à 0,4 %, et jetez les pansements désinfectés dans un récipient pour risques biologiques.
Dans le cadre de soins post-traitement réalisés à domicile, les pansements retirés devront être stockés dans un contenant dédié pour sa prise en charge en filière DASRI.
Exposition accidentelle
Nettoyer toutes les surfaces susceptibles d'avoir été en contact avec la suspension ou le gel beremagene geperpavec (B-VEC) et traiter toutes les éclaboussures avec un agent virucide tel que l'alcool isopropylique à 70 %, le peroxyde d'hydrogène à 6 % ou le chlorure d'ammonium à <0,4 % et éponger à l'aide de matériaux absorbants.
Liste I
Médicament réservé à l'usage hospitalier.
Prescription réservée aux spécialistes en dermatologie.
Suspension et gel pour gel à usage cutané.
Beremagene geperpavec (B-VEC) est jaune opalescent à incolore après sa décongélation. Le gel est une solution visqueuse claire après décongélation.
Chaque carton de beremagene geperpavec (B-VEC) contient un flacon unidose de suspension beremagene geperpavec (B-VEC) et un flacon unidose de gel.
La suspension beremagene geperpavec (B-VEC) se présente sous la forme d'une solution sans conservateur d'un volume extractible de 1 ml contenant 5×109 PFU/ml dans un flacon unidose à usage unique muni d'un bouchon vert.
Le gel est fourni avec un volume de remplissage de 1,5 ml dans un flacon séparé à usage unique et à dose unique avec un bouchon bleu.
1.1. Description générale
Beremagene geperpavec (B-VEC) est un vecteur de thérapie génique à réplication défectueuse basé sur le HSV-1 qui a été génétiquement modifié pour exprimer la protéine du collagène humain de type VII (COL7).
1.2. Composition qualitative et quantitative
Chaque flacon de beremagene geperpavec (B-VEC) contient 1 ml de volume extractible de suspension à une concentration nominale de 5×109 PFU/mL.
Chaque flacon de gel contient un volume total de 1,5 ml.
La suspension beremagene geperpavec (B-VEC) est mélangée au gel avant l'administration. Après mélange, le gel beremagene geperpavec (B-VEC) contient 5,0×109 PFU dans un volume total de 2,5 ml.
Ni la suspension beremagene geperpavec (B-VEC) ni le gel ne contiennent de conservateurs. Beremagene geperpavec (B-VEC) est produit à partir de cellules complémentaires transduites. Pour la liste complète des excipients, voir rubrique Liste des excipients.
Produit pharmaceutique dans une solution de 100,0 mL/L de glycérol, 8,0 mg/mL de chlorure de sodium, 2,16 mg/mL de phosphate de sodium dibasique, 0,2 mg/mL de chlorure de potassium, 0,2 mg/mL de phosphate de potassium monobasique.
Gel contenant au minimum 1,5 ml d'hydroxypropylméthylcellulose à 4,4 % p/p dans une solution de 0,91 mg/ml de trométhamine, 9,0 mg/ml de chlorure de sodium, 0,726 mg/ml de phosphate de sodium dibasique, 0,21 mg/ml de phosphate de potassium monobasique.